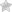При полной ТМА (4,4% всех врожденных пороков сердца) аорта выходит из ПЖ, а ЛА из ЛЖ (вентрикуло-артериальная дискордантность).
МОРФОЛОГИЯ
ТМА может быть осложнена смежными пороками (ДМЖП, обструкция выходного тракта ЛЖ или сразу оба этих порока). ТМА может встречаться как при обычном, так и при зеркальном расположении предсердий. В отличие от нормального сердца в сердце с ТМА присутствуют легкие аномалии взаимоотношения АВ-клапанов с формой МЖП. Однако наиболее очевидной внешней патологией является взаимоотношения аорты и легочным стволом. В большинстве случаев при ТМА с интактным желудочковым клапаном корень аорты расположен спереди и справа от ЛА. Однако могут иметь место и редкие вариации, и они становятся значимыми, когда рассматривается возможность операции по переключению артерий.
ДМЖП при ТМА имеют те же характеристики, что и при обычном сердце. Обструкция выходного отдела ЛЖ, наиболее часто наблюдаемая в сочетании с ДМЖП, обусловлена каудальным сдвигом инфундибулярной части перегородки, что приводит к субпульмональному и пульмональному стенозу. При интактной МЖП обструкция выходного тракта ЛЖ может вызываться аномальным легочным клапаном, динамической субпульмональной обструкцией тракта или, в некоторых случаях, аномальными прикреплениями МК. Анатомия венечных артерий имеет огромное значение с момента начала операций по переносу артерий. Венечные артерии обычно берут начало из передних или задних синусов АК. Наиболее нежелательная патология — наличие интрамурального сегмента в правой или левой проксимальной венечной артерии, что значительно затрудняет перемещение венечной артерии во время операции по переключению артерий [162].
ПАТОФИЗИОЛОГИЯ
При ТМА два круга кровообращения работают параллельно, при этом системный кровоток с низким насыщением крови кислородом направляется обратно в тело, а легочный венозный возврат с высоким насыщением крови кислородом направляется назад в легкие. При замыкании нормальных, характерных для плода шунтов смешивание в пределах кровообращения не наблюдается, и без раннего вмешательства происходит быстрое развитие глубокой гипоксемии с ацидозом. Если овальное окно остается открытым, то смешение крови на уровне предсердий может обусловливать в значительной степени «эффективный» ток легочной крови.
У пациентов с ТМА и интактной МЖП цианоз проявляется вскоре после рождения и развивается очень быстро. Может проявляться дифференцированный цианоз, при котором нижние конечности имеют более розовую окраску, чем верхние конечности, что обусловлено током крови из ЛА в аорту через артериальный проток.
ДИАГНОСТИКА
КЛИНИЧЕСКИЕ ПРИЗНАКИ
Симптомы заключаются в цианозе, значительном импульсе ПЖ, слабых среднесистолических шумах и одинарном II тоне. У пациентов с сопутствующим ДМЖП или большим открытым артериальным протоком цианоз проявляется не так быстро и не в такой степени.
РЕНТГЕНОГРАФИЯ ГРУДНОЙ КЛЕТКИ
Классические признаки — leavocardia (при декстрокардии) с нормальным или слегка повышенным кардиоторакальным отношением, с «яйцом сбоку», обусловленным переднезадним взаимоотношением магистральных артерий. Легочные сосудистые точки слегка акцентированы.
ЭЛЕКТРОКАРДИОГРАФИЯ
Этот вид исследования не поможет в диагностике, но покажет синусовый ритм, смещение электрической оси сердца вправо и гипертрофию ПЖ.
ЭХОКАРДИОГРАФИЯ
Поперечная ЭхоКГ дала возможность определять ТМА напрямую. Применение множества проекций и серийных исследований обусловливает тот факт, что при первичном обследовании ангиография не играет никакой роли или ее значение очень мало. Важные признаки, определяемые при помощи эхокардиографии:
подтверждение АВ-конкордантности и ВА-дискор-дантности;
оценка адекватности межпредсердного сообщения;
оценка любых ДМЖП;
исключение обструкции выхода ЛЖ;
подтверждение нормальной структуры полулунных клапанов;
оценка пространственных взаимоотношений магистральных артерий;
оценка проходимости артериального протока;
исключение коарктации аорты;
детальная оценка анатомии венечных артерий.
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ
Без быстрого лечения ТМА является смертельным состоянием, и 90% пациентов умирают в течение первого года жизни. Ассоциированные пороки развития обусловливают клинические проявления и лечение.
ЛЕЧЕНИЕ И ОТДАЛЕННЫЙ ИСХОД
Раннее лечение направлено на улучшение смешивания двух кругов кровообращения для повышения насыщения артериальной крови кислородом по большому кругу. Это достигается путем поддержания проходимости артериального протока с помощью инфузии простагландина и/или путем увеличения межпредсердного сообщения с помощью баллонной артериальной септостомии. Вмешательство можно выполнить под управлением эхо, которое также позволит оценить адекватность получившихся ДМПП.
В течение многих лет производились операции Мустарда или Сеннинга. В обоих случаях необходимо создание интраатриального отвода, чтобы перенаправить системный и легочный венозный отток в ЛА и аорту соответственно [162]. Таким образом, специалист по врожденным заболеваниям сердца у взрослых должен понимать суть интраатриальной пластики и ее последствий, несмотря на то что данное хирургическое вмешательство сейчас замещается операцией по переключению артерий.
В процессе длительного постоперационного наблюдения после процедур Мустарда и Сеннинга обнаружились некоторые осложнения, а отдаленные результаты оказались неутешительными [73, 163]. Проблемы венозной проходимости (включая стеноз и несостоятельность отвода) могут потребовать вмешательства и интервенционной катетеризации (например, установки стента).
Оказалась неизбежной прогрессирующая потеря устойчивого синусового ритма, что проявляется одинаково часто как после операций Мустарда, так и Сеннинга [164].
Характерен перекрестный ритм с брадикардиями и тахикардиями. Часто применяли вживление пейсмейкера, но улучшения по выживаемости зафиксировано не было. Пейсмейкер следует применять в редких случаях у пациентов с симптомной брадикардией или у тех, кому нужна антиаритмическая терапия при тахикардии (совместно с брадикардией). Вопрос, вызывающий наибольшие опасения, это судьба ПЖ, обеспечивающего системный кровоток. У многих отмечалось развитие правожелудочковой дисфункции одновременно с трикуспидальной регургитацией [166]. Сочетание предсердной тахикардии, рестрикции венозных путей и правожелудочковой дисфункции является фактором риска внезапной смерти на поздних сроках, которая может случиться во время или после физической нагрузки [167].
Остается сложным вопрос о стратификации риска и лечении. С сомнительными результатами использовались иАПФ, поэтому, возможно, лучше использовать p-блокаторы. Таким пациентам требуется постоянное наблюдение в специализированных отделениях для взрослых с врожденными заболеваниями сердца [168].
Для некоторых пациентов можно рассматривать вариант трансплантации или проведение артериального переключения. Однако неочевидна польза такого лечения, и ЛЖ необходимо «переобучать» с помощью перевязки ЛА, чтобы он мог справиться с системным кровообращением. Растущее количество отсроченных проблем после операций по артериальному перенаправлению привело к повсеместному распространению артериального переключения в неонатальном периоде (анатомическая репарация) [169].
У пациентов с интактной МЖП такую процедуру нужно выполнить в течение первых нескольких недель (в идеальном случае lt;4 нед жизни) до того, как упадет давление в ЛЖ и произойдет «разгрузка». Ранняя смертность сейчас находится на очень низком уровне. Среднесрочные данные говорят о прекрасной выживаемости, с более низкой частотой появления аритмии и сохранением желудочковой функции [170]. Изменение в хирургическом подходе от интраатриального к артериальному переключению представляет собой важный аргумент в пользу пожизненного наблюдения пациентов с врожденными заболеваниями сердца при тесном сотрудничестве педиатрических и взрослых кардиологов, занимающихся врожденными пороками. Потенциальные долгосрочные проблемы после артериального переключения, особенно связанные с регургитацией из «неоаорты» и проходимости венечных артерий, требуют отдельной оценки [171].
Детям с ТМА и большим ДМЖП или большим артериальным протоком операция по артериальному переключению с закрытием ДМЖП/открытого артериального протока в идеале должна быть выполнена в течение первых двух месяцев жизни. При наличии ДМЖП и пульмонального стеноза в младенчестве может потребоваться установка паллиативного системно-легочного шунта с последующей репарацией, что обычно влечет за собой внедрение ПЖ в канал ЛА (операция Растелли) [171].
Центральный цианоз часто является первым симптомом врожденного порока сердца. В данной главе приведены ВПС, для которых артериальная гипоксемия — ведущий синдром, несмотря на то, что некоторым из них свойственна также сердечная недостаточность. Причины гипоксемии при ВПС следующие: 1) шунт крови справа налево; 2) уменьшение легочного кровотока; 3) разобщение малого и большого кругов кровообращения.
Транспозиция магистральных артерий (ТМА) представляет собой порок, при котором аорта отходит от морфологически правого желудочка и несет венозную кровь к тканям организма, а легочная артерия отходит от морфологически левого желудочка и несет артериальную кровь к легким.
Среди новорожденных частота транспозиции магистральных сосудов составляет 0,22-0,33 на 1000, среди всех ВПС — 6—7%, среди критических ВПС — до 23%.
Нарушения гемодинамики во многом определяются конкретно представленным вариантом порока:
1) ТМА с интактной межжелудочковой перегородкой;
2) ТМА с интактной межжелудочковой перегородкой и сужением выводного отдела левого желудочка;
3) ТМА с ДМЖП;
4) ТМА с ДМЖП и сужением выводного отдела левого желудочка.

Дефект межжелудочковой перегородки добавляет к симптомам гипоксемии симптомы объемной перегрузки желудочков, легочный стеноз ограничивает легочный кровоток. Однако основой патологии во всех случаях является анатомическое разделение малого и большого кругов кровообращения. При этом венозная кровь, притекающая в правый желудочек, поступает в аорту и, пройдя большой круг кровообращения (БКК), через полые вены вновь возвращается в правые отделы сердца. Артериальная кровь, притекающая в левый желудочек, поступает в легочную артерию и, пройдя малый круг кровообращения (МКК), через легочные вены вновь возвращается влевые отделы сердца. Таким образом, в БКК постоянно циркулирует кровь с низким содержанием кислорода, а в МКК — с высоким.
Естественно, при таких обстоятельствах длительное существование организма невозможно. Условием его выживания является наличие коммуникаций между кругами кровообращения, наиболее часто -открытого овального окна; при этом необходимо наличие двухстороннего сброса крови (так как односторонний сброс привел бы к переполнению одного из кругов кровообращения). От объема потоков, которыми «обмениваются» правые и левые отделы сердца, зависит уровень системной оксигенации. В наилучшей степени двухсторонний кровоток обеспечивает межпредсердное сообщение, так как давление в предсердиях сравнительно низкое, и его изменение на 1—2 мм рт. ст. сказывается на направлении потока крови. Оптимальным для гемодинамики является сочетание открытого овального окна с небольшим ОАП. При этом приток венозной крови в легкие осуществляется преимущественно через ОАЛ, а артериальной в большой круг кровообращения — через межпредсердное сообщение.
У больных с транспозицией магистральных сосудов существует резкий контраст между газовым составом крови в легочных венах и аорте. Так как газообмен в легких не нарушен, в оттекающей от них крови р02 может достигать 110 ммрт. ст., а рС02 составляет 15-25 мм рт. ст. В то же время в системной «артериальной» крови рО, редко превышает 35 мм рт. ст., а рС02 равно приблизительно 45 мм рт. ст. Придыхании 100% кислородом системное рО, обычно поднимается не более чем на 5—10 мм рт. ст. и отражает величину межциркуляторного смешивания крови.
Величина легочного кровотока определяется анатомией порока. При простой транспозиции магистральных сосудов он несколько усилен за счет увеличения минутного объема сердца как одного из механизмов компенсации гипоксемии. Значительная гиперволемия МКК возникает при большом диаметре ОАП или сопутствующем ДМЖП. При сужении выхода из левого желудочка легочный кровоток уменьшен.
Фетальная ЭхоКГ.
Так как транспозиция магистральных сосудов не сопровождается кардиомегалией и редко сочетается с хромосомными аномалиями, процент ее выявления при акушерском скрининге не превышает 19%. Правильное заключение возможно, если исследуются выводные тракты желудочков. При этом выявляют параллельное, а не перекрещивающееся положение магистральных сосудов. В дальнейшем устанавливают, что аорта отходит от морфологически правого, а легочная артерия — от морфологически левого желудочка.
Естественное течение транспозиции магистральных сосудов. В силу особенностей внутриутробного кровообращения транспозиция магистральных сосудов практически не влияет на развитие плода, верхняя и нижняя половины тела оксигенируются адекватно.
В случаях, когда диагноз поставлен, следует обратить внимание на функцию овального окна и ОАП. В 4-6% наблюдений уже пренатально можно выявить симптомы их рестриктивности (фиксированное выбухание межпредсердной перегородки в левое предсердие, малый диаметр ОАП с высокоскоростным потоком крови в нем), приводящей к ранней неонатальной смертности. Родоразрешение рекомендуется проводить в учреждении, располагающем возможностями для терапии простагландинами и выполнения процедуры Рашкинда. Порок относится ко 2-й категории тяжести.
В большинстве случаев ребенок рождается в срок, с нормальным весом. В первые часы после рождения не возникает обычного для новорожденных резкого перераспределения крови в сторону легких и отсутствует возврат большого объема крови из них в левое предсердие. Кроме того, в правом желудочке сохраняется повышенное давление, так как он изгоняет кровь в аорту. В результате давление в правом предсердии сохраняется более высоким, чем в левом и клапан овального окна не закрывается. Кроме того, через ОАП существует двунаправленный поток крови (в систолу — из легочной артерии в аорту, в диастолу — из аорты в легочную артерию). Данные механизмы поддерживают некоторое время удовлетворительную системную оксигенацию крови. Однако уже через несколько часов развивается дефицит кислорода, усиливаются анаэробный метаболизм и продукция лактата, истощаются запасы гликогена. Развиваются метаболический ацидоз и нарушения функции различных органов. Это сопровождается быстрой гибелью больных: 30% умирают на первой неделе жизни, 50% — в периоде новорожденности и 90% — в течение первого года жизни.
Относительно благоприятный прогноз имеют больные с большим межпредсердным сообщением или при комбинации транспозиции магистральных артерий с ДМЖП и с умеренным легочным стенозом. Однако при изолированном большом ДМЖП легочная гипертензия определяется уже к 3—4 мес и быстро приобретает склерозирующий характер. В связи с этим рекомендуют выполнять раннюю операцию.