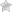Активное клиническое применение тромболитических препаратов и методов эндоваскулярных вмешательств при остром коронарном синдроме позволило снизить смертность от инфаркта миокарда, но привело к осознанию того, что восстановление кровотока в ишемизированном миокарде вызывает дополнительное повреждение сердечной мышцы. Реперфузионное повреждение миокарда требует понимания его механизмов и внедрения в клиническую практику новых способов защиты .
Патогенез ишемического повреждения миокарда
Чаще всего в основе развития ишемического повреждения миокарда лежит нарушение притока артериальной крови по одной коронарных артерий, возникающее чаще всего в результате тромбоза артерии в месте разрыва атеросклеротической бляшки.
При ишемии наиболее ранние изменения возникают в системе энергетического метаболизма кардиомиоцитов. Так, транспорт электронов по дыхательной цепи митохондрий и образование АТФ путем окислительного фосфорилирования прекращаются в течение нескольких секунд после наступления полной ишемии. Практически одновременно происходит активация ключевых ферментов гликогенолиза (фосфорилазы) и гликолиза (фосфофруктокиназы). Дополнительная активация фосфорилазы осуществляется за счет высвобождения катехоламинов из ишемизированных нервных окончаний и стимуляции β-адренорецепторов кардиомиоцитов с последующим возрастанием внутриклеточной концентрации циклического аденозинмонофосфата. В итоге гликоген включается в гликолитический путь.
Запасы высокоэнергетических фосфатов, среди которых важнейшую роль играет АТФ, в миокарде невелики. При острой ишемии потребность в АТФ многократно превышает скорость ее образования, и единственным ее источником при этом является гликолиз. Гликолитическая продукция АТФ также быстро снижается вследствие накопления в миокарде конечных продуктов гликолиза — протонов, лактата и НАДН.
Отсутствие кислорода и торможение гликолиза являются не единственными причинами снижения уровня АТФ в ишемизированном миокарде. Снижению АТФ при ишемии также способствует нарушение ее транспорта из митохондрий и активация некоторых циклических метаболических процессов, в ходе которых происходит усиленная утилизация АТФ. К таким процессам относится избыточный захват кальция (Са 2+ ) в саркоплазматический ретикулум (СР) и его высвобождение из СР, а также распад триглицеридов до свободных жирных кислот с последующим их ресинтезом. Эти процессы усугубляют и без того выраженный энергетический дефицит клеток миокарда.
Метаболические нарушения в ишемизированном миокарде затрагивают также обмен липидов и белков. При ишемии средней тяжести, в частности, при наличии коллатерального кровотока, происходит усиление захвата жирных кислот (ЖК) в зоне ишемии. Скорость захвата ЖК при этом превышает скорость их утилизации, что приводит к накоплению избытка свободных ЖК, ацил-КоА и ацилкарнитина, которые в высоких концентрациях обладают выраженным повреждающим действием в отношении функций сарколеммы и митохондрий.
При тяжелой ишемии происходит полное угнетение митохондриального окисления ЖК и единственным источником энергии служит анаэробный метаболизм глюкозы. Наступление лактат-ацидоза и гибель клетки при этом происходят значительно быстрее.
Важнейшим следствием нарушений энергетического метаболизма миокарда в ранней стадии ишемии является его сократительная дисфункция, возникающая в результате:
Истощения запасов высокоэнергетических фосфатов, в первую очередь, АТФ и креатинфосфата.
Накопления конечных продуктов метаболизма, в частности, протонов (Н + ), лактата, неорганического фосфата и пуриновых оснований, которые создают «осмотическую нагрузку».
Развития внутриклеточного ацидоза, ухудшающего сократительную функцию вследствие вытеснения Са 2+ из актомиозиновых комплексов.
Резкого сниженя перфузионного давления в дистальных сосудах ишемизированного отдела сердца, что изменяет биомеханические свойства стенки ЛЖ.
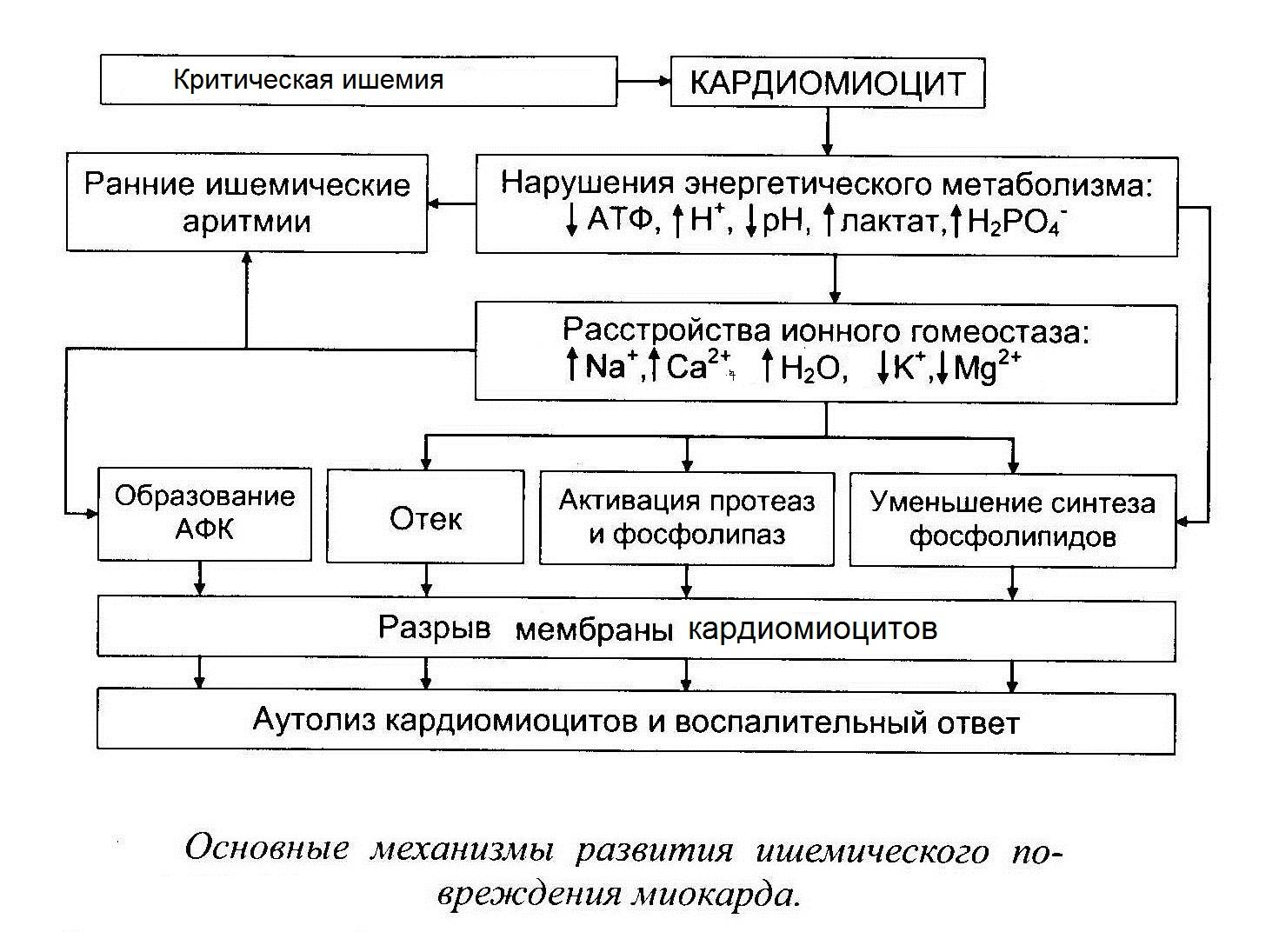
В раннем периоде ишемии происходит возрастание внутриклеточной концентрации Са 2+ , вследствие его поступления по потенциал-зависимым Са 2+ каналам, выхода его из СР, а также возрастания его притока в результате активации «обратного» варианта работы Na + /Ca 2+ обменника (выведение Na + из клетки в обмен на поступающий внутрь нее Са 2+ ). Данный вариант работы Na + /Ca 2+ обменника активируется в ходе ишемии вследствие повышения внутриклеточной концентрации Na + , поступающего в клетку в обмен на протоны, выводимые Na + /H + насосом для компенсации внутриклеточного ацидоза. Повышение внутриклеточной концентрации Са 2+ является ключевым звеном патогенетической цепи, ведущей к необратимому повреждению кардиомиоцитов, т.к. приводит активации Са 2+ -зависимых протеаз, липаз и фосфолипаз, ингибированию биологического окисления в митохондриях и их повреждению, деполяризации сарколеммы и ишемической контрактуре кардиомиоцитов.
Критическим событием в патогенезе ишемического повреждения миокарда является переход обратимой стадии повреждения в необратимую. Последняя характеризуется гибелью кардиомиоцитов в результате некроза и апоптоза.
Важнейшим механизмом необратимого повреждения кардиомиоцитов является нарушение целостности их мембраны посредством следующих механизмов:
Активация перекисного окисления липидов.
Усиленное образование амфифильных липидов, к которым относятся свободные ЖК, ацил-КоА, ацилкарнитин и лизофосфолипиды, нарушающих активность интегральных мембранных белков — ферментов, рецепторов и ионных каналов.
Активация лизосомальных ферментов.
Активация протеаз которые разрушают цитоскелета кардиомиоцитов.
Распространение зоны некроза в ишемизированном миокарде происходит в виде «волны клеточной гибели», зарождающейся в субэндокарде и постепенно, с течением времени, распространяющейся по направлению к эпикардиалъной поверхности. Это объясняется тем, что внутренние слои миокарда наиболее удалены от проходящих субэпикардиально коронарных артерий и, кроме того, подвергаются наибольшему механическому сдавлению в систолу.
Временное улучшение может быть получено при уменьшении потребности миокарда в кислороде с помощью лекарственных препаратов (β-блокаторов) или за счет улучшения коронарного кровотока (нитраты, антагонисты кальция). При этом, однако, могут появиться повторные ишемические эпизоды.
Единственным реальным способом лечения гибернирующего миокарда является своевременная реваскуляризация, выполненная в сроки до развития необратимых морфологических изменений в миокарде.
Фиксированная и динамическая обструкция коронарных артерий
Фиксированная коронарная обструкция вызывает постоянное снижение кровотока, как правило, соответствующее степени атеросклеротического сужения коронарных артерий. Клинические проявления ишемии миокарда у больных с фиксированной коронарной обструкцией, как правило, развиваются при сужении коронарной артерии, превышающем 70%.
Динамическая обструкция связана: (1) с повышением тонуса и спазмом коронарной артерии, (2) тромбообразованием. Присоединение динамического компонента обструкции приводит к появлению эпизодов ишемии даже при гемодинамически незначимом сужении коронарной артерии.
Для характеристики тяжести коронарной обструкции большое значение имеет не только степень сужения коронарных артерий в покое, но и выраженность снижения коронарного резерва. Под коронарным резервом понимают способность коронарных сосудов к дилатации и, как следствие, увеличению кровотока при повышении нагрузки на сердце.
Развитие динамической обструкции при атеросклеротическом поражении коронарных сосудов обусловлено нарушением реактивности коронарных артерий и активацией тромбогенных механизмов. Этим процессам способствует системная эндотелиальная дисфункция, возникающая, например, при гипергомоцистеинемии, сахарном диабете, дислипопротеинемии и других заболеваниях.
Нарушения реактивности пораженных атеросклерозом коронарных артерий обусловлены следующими механизмами:
Снижение образования вазодилататоров;
Уменьшение биодоступности вазодилататоров;
Повреждением гладкомышечных клеток коронарных сосудов.
Повышение тромбогенности при атеросклеротическом повреждении коронарных артерий и ишемии объясняется следующими факторами:
Повышением образования тромбогенных факторов (тканевого тромбопластина, ингибитора активатора плазминогена, фактора Виллебранда и др.);
Уменьшением образования атромбогенных факторов (антитромбина III, протеинов C и S, простациклина, NО, тканевого активатора плазминогена и др.).
Значение динамической обструкции повышается при повреждении эндотелия и дестабилизации атеросклеротической бляшки, что приводит к активации тромбоцитов, развитию локального спазма и острых тромботических окклюзионных осложнений, в частности, острого коронарного синдрома.
Таким образом, атеросклеротическое поражение коронарных сосудов, помимо механического уменьшения просвета сосуда (фиксированной обструкции), может быть причиной динамической обструкции.
Феномен обкрадывания
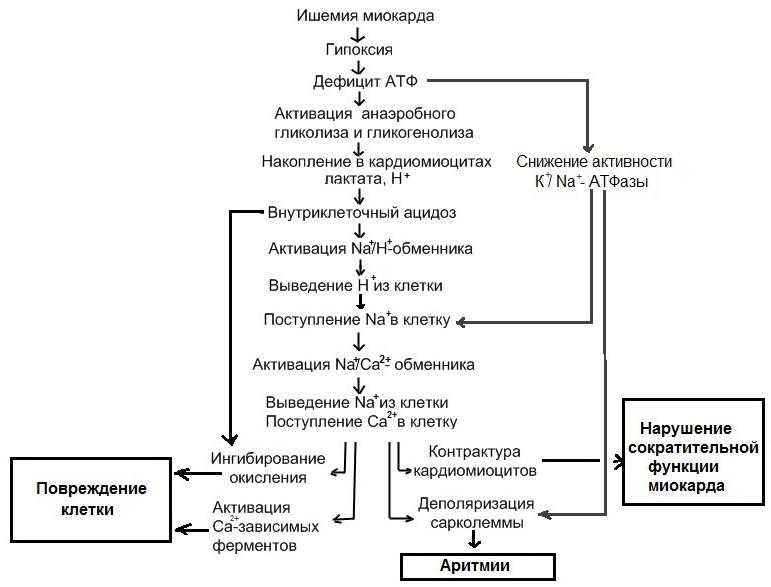
Феномен обкрадывания коронарного русла заключается в резком уменьшении коронарного кровотока в зоне миокарда, снабжаемого кровью из частично или полностью обтурированной коронарной артерии при увеличении количества вазодилататоров, а также при физической нагрузке.
Феномен обкрадывания возникает в результате перераспределения кровотока и может формироваться как в пределах бассейна одной эпикардиальной артерии (внутрикоронарное обкрадывание), или между бассейнами кровоснабжения различных коронарных артерий при наличии коллатерального кровотока между ними (межкоронарное обкрадывание).
При внутрикоронарном обкрадывании в состоянии покоя имеется компенсаторное максимальное расширение артерий субэндокардиального слоя с потерей их чувствительности к вазодилататорам, в то время как артерии эпикардиального (наружного) слоя еще сохраняют способность к расширению под действием вазодилататоров. При физической нагрузке или преобладания гуморальных вазодилататоров происходит быстрое расширение артерий эпикарда. Это приводит к уменьшению сопротивления на отрезке «постстенотический участок — эпикардиальные артериолы» и перераспределению кровотока в пользу эпикарда с обеднением субэндокардиального кровоснабжения.
Рис. 1.9. Механизм феномена внутрикоронарного обкрадывания
(по Gewirtz Н., 2009).
При межкоронарном феномене обкрадывания выделяют «донорский» отдел сердца, получающий кровь из нормальной артерии, и «акцепторный» отдел, лежащий в зоне васкуляризации стенозированной артерии. «Донорский» отдел в покое кровоснабжает регион-«акцептор» за счет коллатералей. В этих условиях артериолы «акцепторного» региона находятся в состоянии субмаксимальной дилатации и практически нечувствительны к вазодилататорам, а артерии «донорского» региона в полной мере сохраняют способность к дилатации. Возникновение вазодилататорного стимула приводит к расширению артериол региона-«донора» и перераспределению кровотока в его пользу, что вызывает ишемию акцепторного региона. Чем более развиты коллатерали между нормальным и ишемизированным отделами сердца, тем больше вероятность межкоронарного обкрадывания.
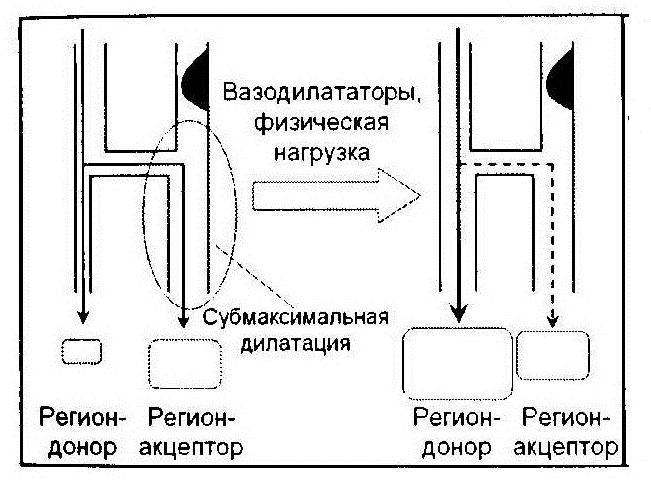
Рис. 1.9. Механизм феномена межкоронарного обкрадывания
1. Нарушается энергетическое обеспечение миокарда. Ухудшается снабжение миокарда кислородом, что приводит к нарушению образования энергии в
митохондриях в связи с падением активности как окисления глюкозы, так и (3-окисления жирных кислот. Накапливаются жирные кислоты, оказывающие детергентное действие на миокард. Неполностью метаболизированные продукты Р-окисления жирных кислот усиливают разобщение процессов гликолиза и
окислительного декарбоксилирования, что еще больше нарушает образование АТФ. В результате содержание АТФ и КФ резко снижается и развивается основной метаболический признак ишемии миокарда — отставание скорости синтеза макроэргических соединений от потребности в них миокарда. Известно,
что через несколько секунд после развития тотальной ишемии миокарда запасы КФ истощаются полностью, а через 40 мин запасы АТФ уменьшаются на 90%.
Вследствие потери кардиомиоцитами изоэнзимов КФК нарушается транспорт АТФ к местам ее утилизации.
Нарушается электролитный баланс в кардиомиоцитах, что обусловлено нарушением энергетического обеспечения работы ионных насосов. В клетках миокарда накапливаются ионы натрия, вызывающие набухание клеток, а также ионы кальция, что приводит к развитию контрактуры сократительных клеток, понижению растяжимости миокарда, повышению напряжения в стенке миокарда, и, следовательно, повышению потребности миокарда в кислороде (замыкается порочный круг).
3. Повышенное содержание кальция в кардиомиоцитах активирует перекисное окисление липидов (ПОЛ) и фосфолипазы, повреждающие митохондрии и цитоплазматическую мембрану кардиомиоцитов.
4. Вследствие накопления лактата развивается метаболический ацидоз, активирующий лизосомальные гидролазы, повреждающие клетки миокарда. Кроме того, ионы водорода начинают конкурировать с кальцием за места связывания на тропонине, что угнетает сократительную функцию сердечной мышцы.
5. После восстановления коронарного кровотока (снятие спазма коронарных сосудов, лизирование тромба и т.д.) может развиться реперфузионное повреждение миокарда (см. метод, пособие «Молекулярные механизмы повреждения клеток».
КЛИНИЧЕСКИЕ ФОРМЫ ИБС
1. Внезапная коронарная смерть (первичная остановка сердца)
2.2.Спонтанная стенокардия (стенокардия покоя)
3. Инфаркт миокарда
4. Постинфарктный кардиосклероз
5. Нарушения сердечного ритма (с указанием формы)
6. Сердечная недостаточность (с указанием формы и стадии).
В настоящее время выделяют такие новые ишемические синдромы, как:
«гибернация» миокарда, «оглушение» миокарда.
Гибернирующий («спящий») миокард — это локальное снижение сократительной способности миокарда левого желудочка, вызванное его длительной
гипоперфузией, которое полностью или частично ликвидируется после улучшения коронарного кровотока. Этот синдром характеризуется следующими
особенностями: коронарный кровоток хронически снижен; отмечается хроническое нарушение сократительной функции миокарда в участках со сниженным
миокардиальным кровотоком; жизнеспособность миокарда сохранена; продолжительность состояния гибернации от нескольких дней до нескольких месяцев
и даже лет. Гибернация миокарда является приспособительной реакцией в ответ на хроническое снижение коронарного кровотока. Функция миокарда снижается, благодаря чему достигается равновесие между потребностью миокарда в кислороде и доставкой его с кровью. Описаны особенности метаболизма в
миокарде при его гибернации. Вначале (приблизительно через первые 10 мин после развития ишемии) в клетках миокарда снижается содержание АТФ и креатинфосфата, кардиомиоциты переходят на анаэробный метаболизм, при этом в миокарде накапливается молочная кислота. При продолжающемся ограничении коронарного кровотока примерно через час анаэробный метаболизм
постепенно уменьшается и прекращается, уровень креатинфосфата восстанавливается, а содержание АТФ далее прогрессивно не снижается. Гибернациямиокарда выявляется у 25-80% больных ИБС. Этот синдром может быть причиной рефрактерности к лечебным мероприятиям при сердечной недостаточности. Радикальный метод лечения этого состояния — хирургическая реваскуляризация.
«Оглушенный» миокард — это состояние, которое сохраняется после реперфузии миокарда несмотря на восстановление коронарного кровотока и отсутствие необратимых изменений в миокарде. Этот феномен может развиться у больных с нестабильной стенокардией; при раннем применении тромболитиков
в остром периоде инфаркта миокарда; при хранении донорского сердца перед его трансплантацией; при наложении дистальных анастомозов во время аортокоронарного шунтирования. Патогенез этого состояния до конца не выяснен. В настоящее время существуют две популярные гипотезы, объясняющие механизм возникновения этого феномена: «кальциевая» гипотеза и «свободнорадикальная» гипотеза. Согласно «кальциевой» гипотезе имеют значение следующие механизмы: снижение чувствительности миокардиальных волокон к кальцию; перегрузка клеток миокарда кальцием; разобщение процессов возбуждения и сокращения вследствие нарушения функции саркоплазматического ретикулума; активация протеинкиназ, фосфолипаз и других катаболических ферментов. В соответствии со свободнорадикальной гипотезой «оглушение» миокарда вызывают свободные радикалы, образующиеся в начале реперфузии. Доказательством может служить положительный эффект применения антиоксидантов (СОД, каталаза), максимально выраженный при назначении их в первые
минуты реперфузии.
ОСТРЫЙ ИНФАРКТ МИОКАРДА
Инфаркт миокарда — одна из клинических форм ишемической болезни сердца, характеризующаяся развитием локального (ограниченного) некроза миокарда вследствие остро возникшего несоответствия коронарного кровотока потребностям миокарда. Инфаркт миокарда (ИМ) является одним из наиболее частых проявлений ИБС и одной из наиболее частых причин смерти в развитых странах, причем около половины смертельных исходов приходится на первый час от начала заболевания. Заболеваемость ИМ значительно увеличивается с возрастом. В молодом и среднем возрасте мужчины болеют им значительно чаще женщин. У женщин в возрасте до 60 лет ИМ встречается в 4 раза реже, чем у мужчин. После наступления менопаузы различия в заболеваемости ИМ среди женщин и мужчин постепенно уменьшаются, а с 70-летнего возраста исчезают. Факторы риска развития ИМ полностью идентичны факторам риска ИБС. Уменьшение частоты развития ИМ обусловлено в первую очередь борьбой с такими факторами риска, как гиперхолестеринемия, артериальная гипертензия,
курение. Основной причиной ИМ является атеросклероз коронарных артерий и развивающийся на этом фоне тромбоз артерии с развитием острой ишемии участка
миокарда. Выраженный атеросклероз коронарных артерий обнаруживается у 957с больных, умерших от ИМ. У большинства больных (50-70%) отмечается
стенозирующий атеросклероз 2-3 магистральных коронарных артерий, при этом просвет артерий уменьшается более, чем на 75%. Примерно в 1,5-7% всех случаев ИМ причиной его развития является неатеросклеротическое поражение коронарных артерий: артерииты различной этиологии, травмы, амилоидоз,
тромбоз in situ при тромбофилшях, врожденные аномалии коронарных артерий т.д.). В этих случаях ИМ является синдромом других заболеваний сердца и коронарных артерий, а не самостоятельной нозологической единицей.
Дата добавления: 2015-08-30 ; просмотров: 2545 . Нарушение авторских прав